ໃນລະຫວ່າງການປະຕິກິລິຍາ PCR, ບາງປັດໃຈແຊກແຊງມັກຈະພົບ.
ເນື່ອງຈາກຄວາມອ່ອນໄຫວຂອງ PCR ສູງຫຼາຍ, ການປົນເປື້ອນໄດ້ຖືກພິຈາລະນາເປັນຫນຶ່ງໃນປັດໃຈສໍາຄັນທີ່ສຸດທີ່ມີຜົນກະທົບຕໍ່ຜົນຂອງ PCR ແລະສາມາດຜະລິດຜົນໄດ້ຮັບໃນທາງບວກທີ່ບໍ່ຖືກຕ້ອງ.
ຄວາມສໍາຄັນເທົ່າທຽມກັນແມ່ນແຫຼ່ງຕ່າງໆທີ່ນໍາໄປສູ່ຜົນໄດ້ຮັບທີ່ບໍ່ຖືກຕ້ອງ - ລົບ.ຖ້າຫນຶ່ງຫຼືຫຼາຍພາກສ່ວນທີ່ສໍາຄັນຂອງປະສົມ PCR ຫຼືປະຕິກິລິຍາການຂະຫຍາຍຕົວຂອງມັນເອງຖືກຍັບຍັ້ງຫຼືແຊກແຊງ, ການວິເຄາະວິນິດໄສສາມາດຂັດຂວາງໄດ້.ນີ້ສາມາດນໍາໄປສູ່ການຫຼຸດລົງປະສິດທິພາບແລະເຖິງແມ່ນວ່າຜົນໄດ້ຮັບທາງລົບທີ່ບໍ່ຖືກຕ້ອງ.
ນອກເຫນືອຈາກການຍັບຍັ້ງ, ການສູນເສຍຄວາມສົມບູນຂອງອາຊິດ nucleic ເປົ້າຫມາຍອາດຈະເກີດຂື້ນເນື່ອງຈາກການຈັດສົ່ງແລະ / ຫຼືເງື່ອນໄຂການເກັບຮັກສາກ່ອນການກະກຽມຕົວຢ່າງ.ໂດຍສະເພາະ, ອຸນຫະພູມສູງຫຼືການເກັບຮັກສາບໍ່ພຽງພໍອາດຈະເຮັດໃຫ້ເກີດຄວາມເສຍຫາຍຂອງຈຸລັງແລະອາຊິດນິວຄລີອິກ.ການສ້ອມແຊມຈຸລັງແລະເນື້ອເຍື່ອແລະການຝັງຕົວຂອງ paraffin ແມ່ນສາເຫດທີ່ຮູ້ຈັກກັນດີຂອງການແຕກແຍກ DNA ແລະບັນຫາທີ່ຍັງຄົງຄ້າງ (ເບິ່ງຮູບ 1 ແລະ 2).ໃນກໍລະນີເຫຼົ່ານີ້, ເຖິງແມ່ນວ່າການໂດດດ່ຽວທີ່ດີທີ່ສຸດແລະການເຮັດຄວາມສະອາດຈະບໍ່ຊ່ວຍໄດ້.
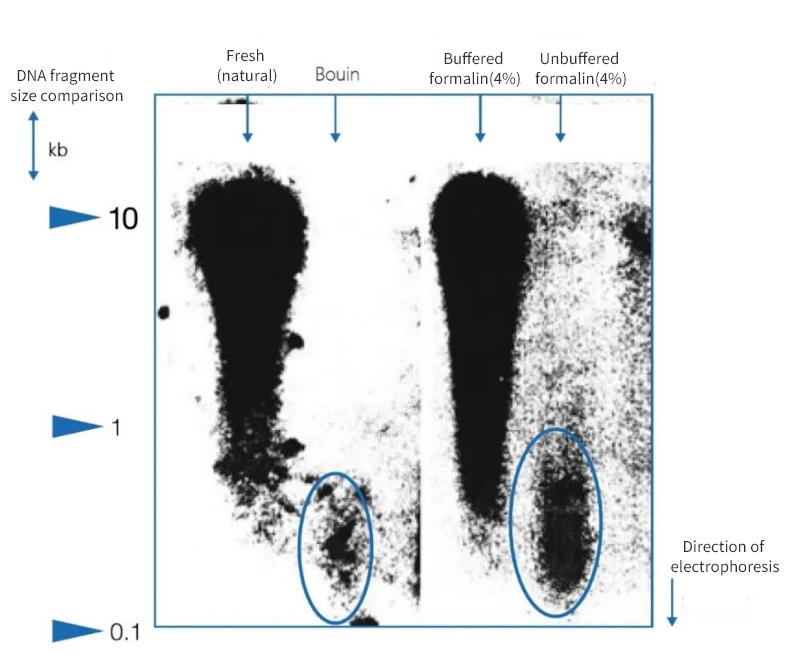
ຮູບທີ 1 |ຜົນກະທົບຂອງ immobilization ກ່ຽວກັບຄວາມສົມບູນຂອງ DNA
Agarose gel electrophoresis ສະແດງໃຫ້ເຫັນວ່າຄຸນນະພາບຂອງ DNA ທີ່ໂດດດ່ຽວຈາກພາກສ່ວນ paraffin ຂອງ autopsies ແຕກຕ່າງກັນຢ່າງຫຼວງຫຼາຍ.DNA ຂອງຄວາມຍາວຂອງຊິ້ນສ່ວນສະເລ່ຍທີ່ແຕກຕ່າງກັນແມ່ນມີຢູ່ໃນສານສະກັດຈາກວິທີການແກ້ໄຂ.DNA ໄດ້ຖືກເກັບຮັກສາໄວ້ພຽງແຕ່ເມື່ອມີການສ້ອມແຊມຢູ່ໃນຕົວຢ່າງແຊ່ແຂງພື້ນເມືອງແລະໃນສານຟໍມາລິນທີ່ເປັນກາງ buffered.ການໃຊ້ສານຕ້ານອະນຸມູນອິດສະລະຂອງ Bouin ທີ່ມີກົດທີ່ເຂັ້ມແຂງຫຼືບໍ່ມີສານຕ້ານອະນຸມູນອິສະລະ, ທີ່ມີກົດ formalin ເຮັດໃຫ້ມີການສູນເສຍ DNA ຢ່າງຫຼວງຫຼາຍ.ຊິ້ນສ່ວນທີ່ຍັງເຫຼືອແມ່ນແຕກແຍກຫຼາຍ.
ຢູ່ເບື້ອງຊ້າຍ, ຄວາມຍາວຂອງຊິ້ນແມ່ນສະແດງອອກເປັນຄູ່ກິໂລຖານ (kbp)
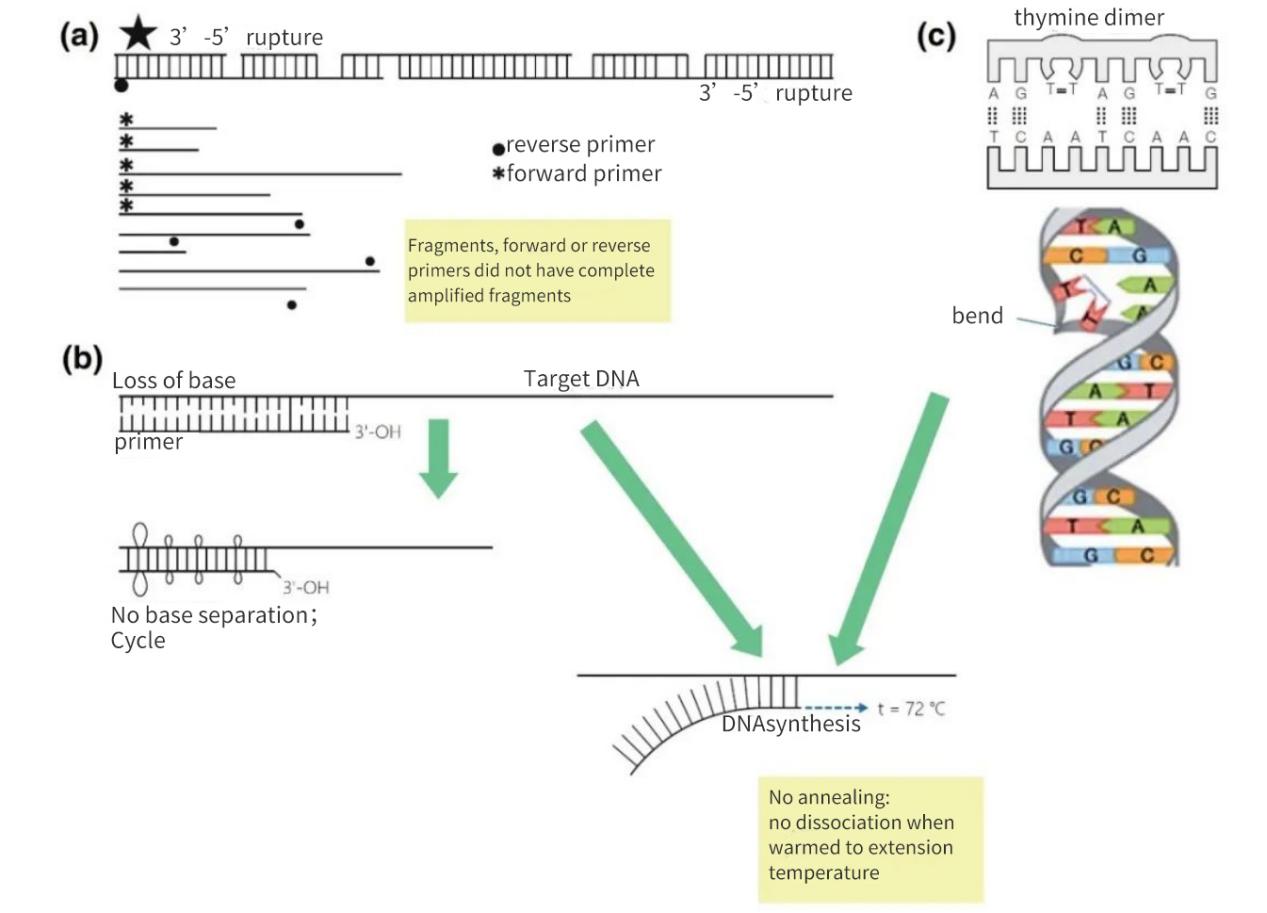
ຮູບທີ 2 |ການສູນເສຍຄວາມສົມບູນຂອງເປົ້າຫມາຍອາຊິດ nucleic
(a) ຊ່ອງຫວ່າງ 3′-5′ ທັງສອງສາຍຈະເຮັດໃຫ້ DNA ເປົ້າໝາຍແຕກຫັກ.ການສັງເຄາະ DNA ຍັງຈະເກີດຂື້ນຢູ່ໃນຊິ້ນສ່ວນນ້ອຍໆ.ຢ່າງໃດກໍຕາມ, ຖ້າສະຖານທີ່ການຫມູນໃຊ້ primer ຫາຍໄປໃນຊິ້ນ DNA, ພຽງແຕ່ການຂະຫຍາຍເສັ້ນແມ່ນເກີດຂື້ນ.ໃນກໍລະນີທີ່ເອື້ອອໍານວຍທີ່ສຸດ, ຊິ້ນອາດຈະຟື້ນຟູເຊິ່ງກັນແລະກັນ, ແຕ່ຜົນຜະລິດຈະມີຂະຫນາດນ້ອຍແລະຕ່ໍາກວ່າລະດັບການກວດພົບ.
(b) ການສູນເສຍພື້ນຖານ, ສ່ວນໃຫຍ່ແມ່ນຍ້ອນ depurination ແລະການສ້າງ thymidine dimer, ນໍາໄປສູ່ການຫຼຸດລົງຂອງຈໍານວນຂອງ H-bonds ແລະການຫຼຸດລົງຂອງ Tm.ໃນລະຫວ່າງໄລຍະການອົບອຸ່ນທີ່ຍືດຕົວ, primers ຈະລະລາຍອອກຈາກ matrix DNA ແລະຈະບໍ່ຖືກຫມຸນເຖິງແມ່ນວ່າພາຍໃຕ້ເງື່ອນໄຂທີ່ເຂັ້ມງວດຫນ້ອຍ.
(c) ຖານ thymine ທີ່ຢູ່ຕິດກັນປະກອບເປັນ TT dimer.
ບັນຫາທົ່ວໄປອີກອັນຫນຶ່ງທີ່ມັກຈະເກີດຂື້ນໃນການວິນິດໄສໂມເລກຸນແມ່ນການປ່ອຍອາຊິດ nucleic ເປົ້າຫມາຍທີ່ຫນ້ອຍກວ່າທີ່ດີທີ່ສຸດເມື່ອທຽບກັບການສະກັດເອົາ phenol-chloroform.ໃນກໍລະນີທີ່ຮ້າຍແຮງ, ນີ້ສາມາດພົວພັນກັບຂໍ້ລົບທີ່ບໍ່ຖືກຕ້ອງ.ເວລາຫຼາຍສາມາດປະຫຍັດໄດ້ໂດຍການຕົ້ມ lysis ຫຼືການຍ່ອຍສະຫຼາຍຂອງ enzymatic ຂອງ debris ຂອງເຊນ, ແຕ່ວິທີການນີ້ມັກຈະເຮັດໃຫ້ຄວາມອ່ອນໄຫວ PCR ຕ່ໍາເນື່ອງຈາກການປ່ອຍອາຊິດ nucleic ບໍ່ພຽງພໍ.
ການຍັບຍັ້ງກິດຈະກໍາໂພລີເມີເຣສໃນລະຫວ່າງການຂະຫຍາຍ
ໂດຍທົ່ວໄປ, ການຍັບຍັ້ງຖືກນໍາໃຊ້ເປັນແນວຄວາມຄິດບັນຈຸເພື່ອອະທິບາຍປັດໃຈທັງຫມົດທີ່ນໍາໄປສູ່ຜົນໄດ້ຮັບ PCR ທີ່ດີທີ່ສຸດ.ໃນຄວາມຮູ້ສຶກທາງຊີວະເຄມີຢ່າງເຂັ້ມງວດ, ການຍັບຍັ້ງແມ່ນຈໍາກັດຕໍ່ກິດຈະກໍາຂອງ enzyme, ie, ມັນຫຼຸດຜ່ອນຫຼືປ້ອງກັນການປ່ຽນ substrate-product ໂດຍຜ່ານປະຕິສໍາພັນກັບສະຖານທີ່ການເຄື່ອນໄຫວຂອງ DNA polymerase ຫຼື cofactor ຂອງມັນ (ເຊັ່ນ: Mg2+ ສໍາລັບ Taq DNA polymerase).
ອົງປະກອບໃນຕົວຢ່າງຫຼື buffers ຕ່າງໆແລະສານສະກັດຈາກ reagents ສາມາດຍັບຍັ້ງ enzyme ໂດຍກົງຫຼືໃສ່ກັບດັກ cofactors ຂອງມັນ (e. g. EDTA), ດັ່ງນັ້ນຈຶ່ງ inactivating polymerase ແລະເຮັດໃຫ້ຜົນໄດ້ຮັບ PCR ທີ່ບໍ່ດີຫຼຸດລົງຫຼືບໍ່ຖືກຕ້ອງ.
ຢ່າງໃດກໍຕາມ, ປະຕິສໍາພັນຫຼາຍລະຫວ່າງອົງປະກອບຕິກິຣິຍາແລະອາຊິດ nucleic ທີ່ມີເປົ້າຫມາຍແມ່ນຍັງຖືກກໍານົດເປັນ 'PCR inhibitors'.ເມື່ອຄວາມສົມບູນຂອງເຊນຖືກລົບກວນໂດຍການໂດດດ່ຽວແລະອາຊິດນິວຄລີອິກຖືກປ່ອຍອອກມາ, ປະຕິສໍາພັນລະຫວ່າງຕົວຢ່າງແລະການແກ້ໄຂອ້ອມຂ້າງຂອງມັນແລະໄລຍະແຂງສາມາດເກີດຂື້ນໄດ້.ຕົວຢ່າງ, 'scavengers' ສາມາດຜູກມັດ DNA ດຽວຫຼືສອງສາຍຜ່ານປະຕິສໍາພັນທີ່ບໍ່ແມ່ນ covalent ແລະແຊກແຊງການໂດດດ່ຽວແລະການຊໍາລະລ້າງໂດຍການຫຼຸດຜ່ອນຈໍານວນເປົ້າຫມາຍທີ່ບັນລຸເຖິງເຮືອປະຕິກິລິຢາ PCR ໃນທີ່ສຸດ.
ໂດຍທົ່ວໄປ, ຕົວຍັບຍັ້ງ PCR ແມ່ນມີຢູ່ໃນນ້ໍາຂອງຮ່າງກາຍສ່ວນໃຫຍ່ແລະທາດ reagents ທີ່ໃຊ້ສໍາລັບການທົດສອບການວິນິດໄສທາງຄລີນິກ (urea ໃນປັດສະວະ, hemoglobin ແລະ heparin ໃນເລືອດ), ອາຫານເສີມ (ອົງປະກອບທາງອິນຊີ, glycogen, ໄຂມັນ, Ca2+ ions) ແລະອົງປະກອບໃນສະພາບແວດລ້ອມ (phenols. , ໂລຫະຫນັກ
| ຢາຍັບຍັ້ງ | ທີ່ມາ |
| ທາດການຊຽມໄອອອນ | ນົມ, ເນື້ອເຍື່ອກະດູກ |
| ຄໍລາເຈນ | ເນື້ອເຍື່ອ |
| ເກືອນໍ້າບີ | ອາຈົມ |
| ເຮໂມໂກບິນ | ໃນເລືອດ |
| ເຮໂມໂກບິນ | ຕົວຢ່າງເລືອດ |
| ອາຊິດ humic | ດິນ, ພືດ |
| ເລືອດ | ເລືອດ |
| Lactoferrin | ເລືອດ |
| (ເອີຣົບ) ເມລານິນ | ຜິວ ໜັງ, ຜົມ |
| ໄມໂກລບິນ | ເນື້ອເຍື່ອກ້າມເນື້ອ |
| Polysaccharides | ພືດ, ອາຈົມ |
| ໂປຣຕີນ | ນົມ |
| ຢູເຣຍ | ຍ່ຽວ |
| Mucopolysaccharide | ກະດູກອ່ອນ, ເຍື່ອເມືອກ |
| Lignin, cellulose | ພືດ |
ຕົວຍັບຍັ້ງ PCR ທີ່ແຜ່ຫຼາຍສາມາດພົບໄດ້ໃນເຊື້ອແບັກທີເຣັຍແລະຈຸລັງ eukaryotic, DNA ທີ່ບໍ່ແມ່ນເປົ້າຫມາຍ, DNA ທີ່ຜູກມັດ macromolecules ຂອງຈຸລັງ matrices ແລະອຸປະກອນຫ້ອງທົດລອງເຊັ່ນ: ຖົງມືແລະພາດສະຕິກ.ການຊໍາລະລ້າງອາຊິດນິວຄລີອິກໃນລະຫວ່າງຫຼືຫຼັງຈາກການສະກັດເອົາແມ່ນວິທີການທີ່ຕ້ອງການສໍາລັບການຖອນຕົວຍັບຍັ້ງ PCR.
ໃນມື້ນີ້, ອຸປະກອນສະກັດອັດຕະໂນມັດຕ່າງໆສາມາດທົດແທນໂປໂຕຄອນຄູ່ມືຈໍານວນຫຼາຍ, ແຕ່ການຟື້ນຕົວ 100% ແລະ / ຫຼືການເຮັດຄວາມສະອາດຂອງເປົ້າຫມາຍບໍ່ເຄີຍບັນລຸໄດ້.ສານຍັບຍັ້ງທີ່ມີທ່າແຮງອາດຈະຍັງມີຢູ່ໃນອາຊິດນິວຄລີອິກທີ່ບໍລິສຸດຫຼືອາດຈະໄດ້ຮັບຜົນແລ້ວ.ມີຍຸດທະສາດທີ່ແຕກຕ່າງກັນເພື່ອຫຼຸດຜ່ອນຜົນກະທົບຂອງ inhibitors.ທາງເລືອກຂອງໂພລີເມີເຣດທີ່ເຫມາະສົມສາມາດມີຜົນກະທົບຢ່າງຫຼວງຫຼາຍຕໍ່ກິດຈະກໍາ inhibitor.ວິທີການພິສູດອື່ນໆເພື່ອຫຼຸດຜ່ອນການຍັບຍັ້ງ PCR ແມ່ນການເພີ່ມຄວາມເຂັ້ມຂົ້ນຂອງ polymerase ຫຼືການນໍາໃຊ້ສານເສີມເຊັ່ນ BSA.
ການຍັບຍັ້ງປະຕິກິລິຍາ PCR ສາມາດສະແດງໃຫ້ເຫັນໄດ້ໂດຍການນໍາໃຊ້ການຄວບຄຸມຄຸນນະພາບຂະບວນການພາຍໃນ (IPC).
ຕ້ອງລະມັດລະວັງເພື່ອເອົາທາດ reagents ແລະວິທີແກ້ໄຂອື່ນໆໃນຊຸດສະກັດອອກ, ເຊັ່ນ: ເອທານອນ, EDTA, CETAB, LiCl, GuSCN, SDS, isopropanol ແລະ phenol, ອອກຈາກອາຊິດນິວຄລີອິກແຍກອອກໂດຍຂັ້ນຕອນການລ້າງຢ່າງລະອຽດ.ອີງຕາມຄວາມເຂັ້ມຂົ້ນຂອງພວກມັນ, ພວກມັນອາດຈະກະຕຸ້ນຫຼືຍັບຍັ້ງ PCR.
ເວລາປະກາດ: ພຶດສະພາ-19-2023
 中文网站
中文网站 